Антибактериальная терапия при хроническом синусите
Л.С. Страчунский, Е.И. Каманин, А.А. Тарасов, И.В. Отвагин, О.У. Cтецюк, М.Р. Богомильский, Ю.М. Овчинников, О.И. Карпов
Смоленская государственная медицинская академия, Российский государственный медицинский университет им. Н.И. Пирогова, Москва, Московская медицинская академия им. М.И. Сеченова, Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова
“Антибиотики и химиотерапия”, 1999, т.44, №9, стр.24-28
Эпидемиология
Синусит относится к числу самых распространенных заболеваний. Острый синусит является наиболее частым осложнением острой респираторной вирусной инфекции (в 5-10%) [1] и с одинаковой частотой встречается во всех возрастных группах. Хронический синусит стоит на первом месте среди всех хронических заболеваний (146/1000 населения) [2]. В среднем около 5-15% взрослого населения и 5% детей страдают той или иной формой синусита [3].
Классификация
Выделяют следующие клинические формы синусита:
I. По длительности заболевания [1]:
- острый синусит (менее 3 месяцев);
- рецидивирующий острый синусит (2-4 эпизода острого синусита за год);
- хронический синусит (более 3 месяцев);
- обострение хронического синусита (усиление существующих и/или появление новых симптомов).
II. По тяжести течения:
- легкое: заложенность носа, слизистые или слизисто-гнойные выделения из носа и/или в ротоглотку, температура тела до 37,5oС, головная боль, слабость, гипосмия; на рентгенограмме околоносовых синусов – толщина слизистой менее 6 мм;
- среднетяжелое: заложенность носа, гнойные выделения из носа и/или в ротоглотку, температура тела более 37,5oС, боль и болезненность при пальпации в проекции синуса, головная боль, гипосмия, может быть иррадиация боли в зубы, уши, недомогание; на рентгенограмме околоносовых синусов – утолщение слизистой более 6 мм, полное затемнение или уровень жидкости в 1 или 2 синусах;
- тяжелое: заложенность носа, часто обильные гнойные выделения из носа и/или в ротоглотку (может быть их полное отсутствие), температура тела более 38oС, сильная болезненность при пальпации в проекции синуса, головная боль, аносмия, выраженная слабость; на рентгенограмме околоносовых синусов – полное затемнение или уровень жидкости более чем в 2 синусах; в общем анализе крови – повышенный лейкоцитоз, сдвиг формулы влево, ускорение СОЭ; орбитальные, внутричерепные осложнения или подозрение на них.
Необходимо отметить, что в каждом конкретном случае степень тяжести оценивается по совокупности наиболее выраженных симптомов. Например, при подозрении на орбитальные или внутричерепные осложнения течение всегда расценивается как тяжелое, независимо от выраженности других симптомов.
Этиология
Основными возбудителями являются:
- при остром синусите – Streptococcus pneumoniae (48%) и Haemophilus influenzae (12%), гораздо реже встречаются Moraxella catarrhalis, Streptococcus pyogenes, Staphylococcus aureus, анаэробы;
- при рецидивирующем остром и обострении хронического синусита спектр и соотношение возбудителей принципиально не отличаются от острого синусита;
- при хроническом синусите большее значение имеют анаэробы (Peptococcus, Bacteroides, Veillonella, Prevotella, Fusobacterium, Corynebacterium), встречаются также S.aureus, Pneumococcus, H.influenzae и грамотрицательные бактерии, грибы.
Чувствительность возбудителей к антибиотикам
Чувствительность основных возбудителей острых синуситов к антибиотикам значительно варьирует в различных регионах. По данным зарубежных исследователей, наблюдается тенденция к нарастанию резистентности пневмококков к бензилпенициллину и макролидам, гемофильной палочки – к аминопенициллинам.
По имеющимся данным, в центральной части России у S.pneumoniae и H.influenzae, выделенных при острых синуситах, сохраняется высокая чувствительность к аминопенициллинам и цефалоспоринам: 97% штаммов S.pneumoniae чувствительны к бензилпенициллину, 100% – к ампициллину, амоксициллину, амоксициллин/клавуланату, цефуроксиму; 100% H.influenzae чувствительны к амоксициллин/клавуланату, 90% – к ампициллину и цефуроксиму.
В России основной проблемой является резистентность пневмококков и гемофильной палочки к ко-тримоксазолу: умеренный и высокий уровень резистентности отмечен у 40% S.pneumoniae и 22% H.influenzae.
Задачи антибиотикотерапии
При остром и обострении хронического синусита
главная цель терапии – это эрадикация инфекции и восстановление стерильности синуса, поэтому основное место в ней занимают антибиотики. Кроме того, по показаниям, применяются пункция синусов и другие специальные методы лечения.
При частом (более 2 раз в год) рецидивирующем и хроническом процессе для успешного лечения необходима тщательная оценка многих дополнительных факторов (анатомия полости носа, сопутствующая патология и т.д.) и проведение комплексной терапии с оперативным вмешательством. Антибиотики здесь не играют ведущей роли и являются частью терапии. Желательно, чтобы выбор препарата в таких случаях основывался на результатах исследования чувствительности микрофлоры, выделенной из синусов.
Выбор антибиотиков
Выбор препарата при острых процессах в подавляющем большинстве случаев проводится эмпирически, на основе имеющихся данных о преобладающих возбудителях и их резистентности в регионе, а также с учетом тяжести состояния (схема).
1 при отсутствии амоксициллина или амоксициллин/клавуланата назначается ампициллин
2 терапия в течение 3 дней
3 у детей старше 8 лет
4 только у взрослых
Схема антибактериальной терапии синуситов [4-7]
При хронических процессах перед назначением антибиотика особенно важно проведение микробиологического исследования содержимого синусов.
При легком течении. В первые дни заболевания, когда наиболее вероятна вирусная этиология, не требуется назначения антибиотиков. Если, несмотря на проводимое симптоматическое лечение, симптомы сохраняются без улучшения более 10 дней или прогрессируют, что косвенно говорит о присоединении бактериальной инфекции, то целесообразно назначение антибактериальной терапии. В этом случае выбор препарата производится, как и при среднетяжелом течении.
При среднетяжелом течении. Препараты выбора: амоксициллин (при отсутствии амоксициллина или амоксициллин/клавуланата назначается ампициллин), амоксициллин/клавуланат.
Альтернативные препараты: цефалоспорины (цефуроксим аксетил, цефаклор), макролиды (азитромицин, кларитромицин), тетрациклины (доксициклин), фторхинолоны (грепафлоксацин).
При тяжелом течении:
- ингибиторзащищенные пенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) парентерально;
- цефалоспорины II-III поколения (цефуроксим, цефтриаксон, цефотаксим, цефоперазон) парентерально;
- при аллергии к b-лактамам: ципрофлоксацин или хлорамфеникол парентерально.
Пути введения антибиотиков
При легком и среднетяжелом течении терапию следует проводить пероральными препаратами (табл. 1).
При тяжелом течении лечение необходимо начинать с парентерального (желательно внутривенного) введения (табл. 2) и затем, по мере улучшения состояния, переходить на пероральный прием (ступенчатая терапия).
Ступенчатая терапия предполагает двухэтапное применение антибактериальных препаратов:
вначале парентеральное введение антибиотика и затем, при улучшении состояния, в возможно более короткие сроки (как правило, на 3-4-й день) переход на пероральный прием этого же или сходного по спектру активности препарата. Например, амоксициллин/клавуланат внутривенно или ампициллин/сульбактам внутримышечно в течение 3 дней, далее амоксициллин/клавуланат внутрь, или цефуроксим внутривенно в течение 3 дней, далее цефуроксим аксетил внутрь.
Таблица 1. Дозы и режимы введения пероральных антибиотиков при лечении острого синусита
| Антибиотики | Режим дозирования | Связь с приемом пищи | |
|---|---|---|---|
| у взрослых | у детей | ||
| Препараты первоочередного выбора | |||
| Амоксициллин | 500 мг х 3 раза/сут | 40 мг/кг/сут в 3 приема | Независимо от еды |
| Ампициллин | 500 мг х 4 раза/сут | 50 мг/кг/сут в 4 приема | За 1 час до еды |
| Амоксициллин/клавуланат | 500 мг х 3 раза/сут или 875 мг х 2 раза/сут | 50 мг/кг/сут в 3 приема | Во время еды |
| Альтернативные препараты | |||
| Цефуроксим аксетил | 250 мг х 2 раза/сут | 30 мг/кг/сут в 2 приема | Во время еды |
| Цефаклор | 500 мг х 3 раза/сут | 40 мг/кг/сут в 3 приема | Независимо от еды |
| Азитромицин | 500 мг х 1 раз/сут, 3 дня | 10 мг/кг/сут в 1 прием, 3 дня | За 1 час до еды |
| Кларитромицин | 500 мг х 2 раза/сут | 7,5 мг/кг/сут в 2 приема | Независимо от еды |
| Доксициклин | 100 мг х 2 раза/сут | 2,2 мг/кг/сут в 1 прием * | Независимо от еды |
| Грепафлоксацин | 400 мг х 1 раз/сут | — | Независимо от еды |
* у детей старше 8 лет.
Таблица 2. Дозы и режимы введения парентеральных антибиотиков при лечении острого синусита
| Антибиотики | Режим дозирования | |
|---|---|---|
| у взрослых | у детей | |
| Цефалоспорины | ||
| Цефуроксим | 0,75-1,5 г х З раза/сут, в/м, в/в | 50-100 мг/кг/сут в 3 введения, в/м, в/в |
| Цефотаксим | 2 г х 2-3 раза/сут, в/м, в/в | 50-100 мг/кг/сут в 3 введения, в/м, в/в |
| Цефтриаксон | 2 г x 1 раз/сут, в/м, в/в | 50-100 мг/кг/сут в 1 введение, в/м, в/в |
| Цефоперазон | 2 г х 3 раза/сут, в/м, в/в | 50-100 мг/кг/сут в 2-3 введения, в/м, в/в |
| Цефтазидим | 2 г х 2-3 раза/сут, в/м, в/в | 50 мг/кг/сут в 2-3 введения, в/м, в/в |
| Цефепим | 2 г х 2 раза/сут, в/м, в/в | 50-100 мг/кг/сут в 2 введения, в/м, в/в |
| Ингибиторзащищенные аминопенициллины | ||
| Амоксициллин/клавуланат | 1,2 г х 3 раза/сут, в/в | 40/мг/сут в 3 введения, в/в |
| Ампициллин/сульбактам | 1,5-2 г х 4 раза/сут, в/м, в/в | 150 мг/кг/сут в 3-4 введения, в/м, в/в |
| Ингибиторзащищенные антисинегнойные пенициллины | ||
| Тикарциллин/клавуланат | 3,1 г х 6 раз/сут, в/в | 75 мг/кг/сут в 4 введения, в/в |
| Фторхинолоны | ||
| Ципрофлоксацин | 500 мг х 2 раза/сут, в/в | — |
| Офлоксацин | 400 мг х 2 раза/сут, в/в | — |
| Пефлоксацин | 1-я доза 800 мг, затем по 400 мг х 2 раза/сут, в/в | — |
| Карбапенемы | ||
| Имипенем | 0,5 г х 4 раза/сут, в/в | 60 мг/кг/сут в 4 введения, в/в |
| Меропенем | 0,5 г х 4 раза/сут, в/в | 60 мг/кг/сут в 4 введения, в/в |
| Антибиотики разных групп | ||
| Хлорамфеникол | 0,5-1 г х 4 раза/сут, в/м, в/в | 50 мг/кг/сут в 4 введения, в/м, в/в |
Длительность терапии
Как правило, зависит от формы и степени тяжести. При остром синусите антибактериальная терапия в среднем проводится в течение 7-10 дней, при обострении хронического – до 3 недель.
Показания к госпитализации:
- тяжелое клиническое течение острого синусита, подозрение на осложнения;
- острый синусит на фоне тяжелой сопутствующей патологии или иммунодефицита;
- невозможность проведения в амбулаторных условиях специальных инвазивных манипуляций;
- социальные показания.
Типичные ошибки при проведении антибиотикотерапии
Наиболее часто встречаются следующие ошибки:
- неправильный выбор препарата (без учета основных возбудителей, спектра активности антибиотика). Например, не следует при остром синусите назначать линкомицин (не действует на H.influenzae), оксациллин (малоактивен против пневмококка, не действует на H.influenzae}, гентамицин (не действует на S.pneumoniae и Н.influenzae). Ко-тримоксазол не может быть рекомендован к широкому применению при синусите в России из-за высокой резистентности к нему S.pneumoniae и Н.influenzae. Ципрофлоксацин также не рекомендуется для амбулаторной практики. Его следует применять для терапии осложненных форм синусита или при непереносимости b-лактамов;
- неверный путь введения препарата. Например, не следует в амбулаторных условиях вводить антибиотики внутримышечно. Основу терапии в поликлинике должен составлять пероральный прием. В условиях стационара при тяжелых формах cинусита по мере улучшения состояния также следует переходить на пероральный прием (ступенчатая терапия);
- неправильный выбор дозы (часто ниже необходимой) и режима дозирования (несоблюдение кратности введения, не учитывается связь с приемом пищи). Например, ампициллин и азитромицин необходимо принимать за 1 час до еды.
Нозокомиальный (внутрибольничный, госпитальный синусит)
К нозокомиальным относят синусит, развившийся через 48 часов после госпитализации. Как правило, он встречается у пациентов, находящихся в реанимационном отделении или палате интенсивной терапии, у которых длительное время (более 3-4 суток) в полости носа находится инородное тело (интубационная трубка, назогастральный зонд, носовые тампоны). Распространенность нозокомиального синусита среди таких пациентов составляет 5-20% [8], а по данным рентгенографии и компьютерной томографии у 90% больных после 7 дней назотрахеальной интубации или нахождения назогастрального зонда есть изменения в околоносовых пазухах [2]. Инфекция максиллярного синуса является наиболее частой причиной лихорадки неясного генеза, иногда она может вызвать внутричерепную инфекцию и сепсис.
Возбудителями нозокомиального синусита могут быть Pseudomonas aeruginosa, грамотрицательные микроорганизмы семейства Enterobacteriaceae (Klebsiella pneumoniae, Escherichia coli и др.), Acinetobacter spp., S.aureus и стрептококки. Реже, преимущественно у пациентов с иммунодефицитными состояниями, возбудителями могут быть грибы и Legionella pneumophila.
Терапию нозокомиального синусита следует начинать с:
- устранения предрасполагающих факторов (удаление носовых катетеров, тампонов, и др.);
- пункции и дренирования пораженного синуса;
- назначения местных деконгестантов.
Выбор антибиотиков для терапии нозокомиального синусита должен проводиться индивидуально, с учетом следующих данных: предшествующей антибактериальной терапии, локальных эпидемиологических данных о распространенности и резистентности нозокомиальных возбудителей.
Для антибактериальной терапии нозокомиальных синуситов рекомендуются:
- амоксициллин/клавуланат + аминогликозиды;
- ампициллин/сульбактам + аминогликозиды;
- тикарциллин/клавуланат + аминогликозиды;
- цефалоспорины III поколения + аминогликозиды;
- цефалоспорины IV поколения (цефепим);
- фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин);
- карбапенемы (имипенем, меропенем).
Все антибиотики необходимо назначать парентерально, предпочтительно внутривенное введение препаратов. В дальнейшем можно переходить на пероральный прием (ступенчатая терапия).
Таблица 3. Список основных торговых названий
антибактериальных препаратов
| Генерическое название | Торговые названия |
|---|---|
| Азитромицин | Сумамед |
| Амоксициллин | Флемоксин солютаб, хиконцил |
| Амоксициллин/клавуланат | Аугментин, амоксиклав |
| Ампициллин/сульбактам | Уназин |
| Грепафлоксацин | Роксар |
| Доксициклин | Вибрамицин |
| Имипнем | Тиенам |
| Кларитромицин | Клацид, фромилид |
| Меропенем | Меронем |
| Офлоксацин | Таривид |
| Пефлоксацин | Пефлацин, абактал |
| Тикарциллин/клавуланат | Тиментин |
| Хлорамфеникол | Левомицетин |
| Цефаклор | Цеклор |
| Цефепим | Максипим |
| Цефоперазон | Цефобид |
| Цефотаксим | Клафоран |
| Цефтазидим | Фортум, тазицеф |
| Цефтриаксон | Роцефин, лендацин, лонгацеф |
| Цефуросим | Зинацеф |
| Цефуроксим аксетил | Зиннат |
| Ципрофлоксацин | Ципробай, ципринол |
Литература
- Lund V., Gwaltney J., Baquero F., Echolos R. et al. Infectious rhinosinusitis in adults: classification, etiology and management. J Ear Nose Throat 1997; 76: Supp;: 22.
- Pankey G.A., Gross C.W., Menctelsohn M.G. Contemporary Diagnosis and Management of Sinusitis. Pennsylvania 1997; 150.
- Gwaltney J.M. Management of acute sinusitis in adults. Infectious Diseases and Antimicrobial Therapy of the Ears, Nose and Throat./ Ed by Johnson J.T., Yu V.L. 1st 1997; 341-349.
- Wald E.R. Management of acute bacterial sinusitis in children. Infectious Diseases and Antimicrobial Therapy of the Ears, Nose and Throat./Ed by Johnson J.T., Yu V.L. 1st 1997; 333-340.
- Wald E.R. Diagnosis and management of sinusitis in children. Ped Infect Dis 1998; 9: 4-11.
- Barllett J.G. 1DCP guidelines: management of upper respiratory tract infections. Sinusitis. Infect Dis Clin Pract 1997; 9: 216-219.
- Отвагин И.В. Фармакоэпидемиологическое и клинико-бактериологическое обоснование применения цефалоспоринов у больных острым синуситом: Автореф дис. … канд мед наук. Смоленск 1998; 22.
- Mevio E., Benazzo М., Quaglieri S., Mencherini S. Sinus infection in intensive care patients. Rhinology 1996; 34: 232-236.
| © 2000-2009 НИИАХ СГМА | ||
Источник

Введение
Современное понимание патогенетических основ развития хронического риносинусита (ХРС) позволяет на сегодняшний день отнести эту патологию к гетерогенной группе заболеваний носа и околоносовых пазух, которые характеризуются воспалением и ремоделированием тканей.
В соответствии с европейской классификацией ХРС подразделяется на хронический риносинусит с полипами и хронический риносинусит без полипов [1]. Диагноз ХРС устанавливается при наличии по крайней мере 2-х симптомов из следующих: заложенность носа, носовая секреция и/или постназальный синдром, головные и/или лицевые боли, снижение обоняния в течение более чем 12 нед. за последний год. Согласно последним данным, различные формы ХРС отличаются также процессом ремоделирования верхних дыхательных путей. Гистологически ХРС без полипов характеризуется фиброзом слизистой оболочки и базальной мембраны, в то время как полипозный риносинусит (ПРС) сопровождается выраженным отеком с отложением альбумина и развитием псевдокист.
Процесс ремоделирования слизистой оболочки полости носа и околоносовых пазух при хроническом воспалении создает условия для ослабления защитных механизмов и в большинстве случаев делает ее более восприимчивой к воздействию различных видов микроорганизмов [2].
При хронических синуситах микробная флора отличается большим разнообразием и спектр возбудителей несколько смещается в пользу анаэробной флоры. Так, по данным ряда авторов, в 52% случаев выделяются аэробы (различные стрептококки – 21%, гемофильная палочка – 16%, синегнойная палочка – 15%, золотистый стафилококк и моракселла − по 10%). Анаэробным возбудителям принадлежит 48% случаев (Prevotella – 31%, анаэробные стрептококки – 22%, Fusobacterium − 15% и др.). Выделение энтеробактерий при синуситах может быть объяснено кишечным дисбактериозом, который рассматривается в настоящее время как побочное действие антибиотикотерапии. По причине дефицита бифидобактерий и молочнокислых бактерий происходит беспрепятственное заселение условно-патогенной микрофлорой не только кишечника, но и других сообщающихся с внешней средой полостей организма. Этим же обстоятельством объясняется выявление грибов рода Candida [3].
Т.Н. Леонтьева и соавт. (1988) при обследовании 200 больных ПРС выявили стафилококковую обсемененность слизистой оболочки полости носа у 70,7% больных ПРС и у 81,5% больных полипозно-гнойным риносинуситом (ПГРС). При ПРС выявлялись в основном условно-патогенные штаммы. В 13,7% определялась стрептококковая флора, представленная в большей степени зеленящим стрептококком и встречающаяся одинаково часто как при ПРС, так и при ПГРС. E. сoli высевалась из отделяемого полости носа в 10,5% случаев. По результатам исследования авторы приходят к выводу, что S. aureus способствует более тяжелому течению заболевания с частыми рецидивами. Флора околоносовых пазух (ОНП) как сапрофитирующая, так и патогенная крайне разнообразна, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентностью возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, а также чувствительностью и резистентностью к инфекции. Наиболее значимыми факторами являются неблагоприятный аллергический фон, частые полипотомии полости носа, нерациональное назначение антибактериальных препаратов, как в виде местной терапии, так и в виде общей антибиотикотерапии.
Особое внимание в последнее время уделяется способности микроорганизмов собираться в сообщества, т. е. формировать биопленки. Доказано, что биопленки оказывают серьезное влияние на свойства и потенциальные возможности образующих их патогенов. В первую очередь речь идет о защитном матриксе, своеобразной среде внутри микроколоний, способности микроорганизмов к элементарным видам взаимодействия между собой. В биопленке бактерия способна продуцировать такие факторы устойчивости, которые не продуцируют планктонные микроорганизмы, не говоря о лабораторных штаммах, а матрикс, окружающий микроколонии, служит защитным барьером, благодаря которому бактерии в биопленке более устойчивы к внешнесредовым влияниям и действию защитных факторов организма. Биопленкообразование широко изучено на золотистом стафилококке. Продемонстрировано, что S. aureus может не только обсеменять слизистую полости носа, но и формировать биопленку на слизистой оболочке, в особенности у пациентов с полипами.
Недавние исследования были посвящены изучению роли биопленок в персистенции S. aureus: биопленки выступают в качестве резервуара для микроорганизмов и позволяют им быстро внедряться в слизистую оболочку [4]. Используя флуоресцентную гибридизацию in situ пептидно-нуклеиновых кислот, было продемонстрировано наличие внутриклеточно расположенного S. aureus в ткани полипов от пациентов с аспирин-индуцированными заболеваниями дыхательной системы [5]. Также было выявлено, что данный микроорганизм располагается интраэпителиально в слизистой полипов, но не присутствует в назальном эпителии пациентов с хроническим риносинуситом без полипоза и у здоровых добровольцев. S. aureus не только выживает, но и размножается внутри эпителиальных клеток назальных полипов [6]. Данные исследований подчеркивают способность S. aureus к персистенции в условиях нарушенного механизма защиты слизистой оболочки. Как известно, Th2 сдвиг воспалительной реакции поддерживает программирование так называемых М2 макрофагов в ткани полипов, у которых, как было показано, снижена способность к фагоцитированию и внутриклеточному лизису S. aureus [7].
Кроме того, предполагается, что S. aureus высвобождает энтеротоксин в ткань полипа лишь в небольшом количестве, что приводит к постоянной стимуляции местной иммунной системы и изменению как врожденного [6], так и адаптивного иммунитета [8]. Все это позволяет бактерии в течение длительного времени выживать в пораженных дыхательных путях. Нами было проведено собственное исследованиею
Цель исследования: повысить эффективность лечения ПРС с учетом изученного влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
Материал и методы
В исследование включено 105 пациентов с ПРС в возрасте от 20 до 65 лет: 65 (62%) женщин и 40 (38%) мужчин. В общем количестве пациентов с ПРС 49 (47%) имели астматическую триаду (ПРС + бронхиальная астма (БА) + непереносимость НПВС), у 32 (38%) пациентов диагностирован только ПРС, у 16 (15%) − ПРС и БА.
Всем пациентам проведено стандартное клиническое обследование, а также обследование, соответствующее заболеванию: оториноларингологический осмотр (передняя и задняя риноскопия, фарингоскопия и т. д.), эндоскопическое исследование полости носа и носоглотки эндоскопами, рентгенологическое исследование − КТ ОНП. Проведено микробиологическое исследование посевов со слизистой оболочки полости носа. Особое внимание, учитывая природу полипозного процесса, мы уделили иммунологическому и аллергологическому исследованиям, которые проводили по стандартной методике, разработанной НИАЛ АМН СССР. Сенсибилизацию к золотистому стафилококку исследовали по уровню специфического IgE крови к стафилококковым энтеротоксинам А, В, TSST.
Для оценки эффективности лечения выполняли указанное комплексное обследование многократно: перед операцией и на контрольных визитах через 6 мес., далее через 1 год после операции или по показаниям.
Всем пациентам выполнена функциональная эндоскопическая риносинусхирургия по поводу ПРС. В послеоперационном периоде все пациенты получали антибактериальную терапию согласно одной из 2-х используемых в данном исследовании терапевтических схем:
1) топические глюкокортикостероиды (ГКС), антигистаминные препараты; через 6 мес. повторный курс лечения в той же дозировке;
2) 1-я схема + антибиотик; через 6 мес. повторный курс лечения в той же дозировке.
Результаты и обсуждение
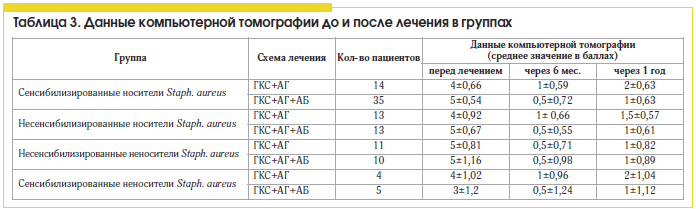
В результате проведенного исследования выявлена высокая распространенность среди пациентов ПРС персистирующей стафилококковой инфекции, которая составляет 71%, и высокая частота встречаемости пациентов, сенсибилизированных к антигенам Staph. aureus, – 55,2%. Установлено, что ПРС, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением, нежели ПРС без носительства (6±0,64 балла и 4±0,84 соответственно) и большей частотой обострений гнойного воспаления ОНП за год (2,7±0,79 и 1,8±0,67 соответственно).
Описанная закономерность объективно объясняется более выраженным эозинофильным воспалением при ПРС, ассоциированным с колонизацией Staph. аureus, чем при ПРС, ассоциированным с инфицированием прочими микроорганизмами (Str. pneumoniae, Str. viridans, Staph. epidermidis, E. coli, K. pneumoniae, H. influenzae, P. аeruginosa), что выражается повышенным количеством эозинофилов в крови (7,98±2,86 и 5,98±3,20 соответственно), в мазках со слизистой оболочки полости носа (13,3±6,20 и 7,87±5,22 соответственно) и средним уровнем эозинофильного катионного протеина (17,5±5,10 и 11,3±6,07 мкг/мл соответственно). Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами: повышение количества эозинофилов в крови (8,26±2,97 и 4,32±1,59 соответственно), в мазках со слизистой оболочки полости носа (13,3±5,54 и 4,8±3,89 соответственно) и повышение среднего уровня эозинофильного катионного протеина (17,6±4,66 и 8,0±6,64 мкг/мл соответственно).
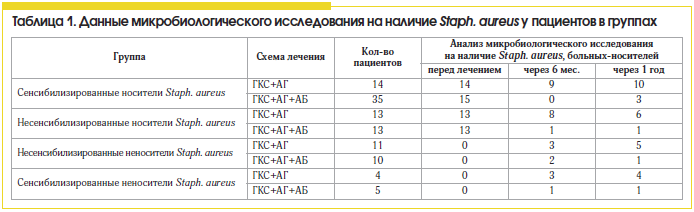
В группах, получавших лечение без антибиотика, положительная эрадикация микрофлоры была достигнута только в 28,5% у сенсибилизированных носителей и в 54% случаев – у несенсибилизированных носителей, что можно расценивать как спонтанную эрадикацию возбудителя на фоне нормализации носового дыхания и аэрации в ОНП, при условии отсутствия сенсибилизации (табл. 1). Обращает на себя внимание тот факт, что у всех пациентов, сенсибилизированных к стафилококку, не получавших антибактериальную терапию и не являвшихся носителями, через год был выявлен рост микрооганизма в значимой концентрации (>104). Это свидетельствует о необходимости проведения бактериологического мониторинга у всех сенсибилизированных к стафилококку пациентов.
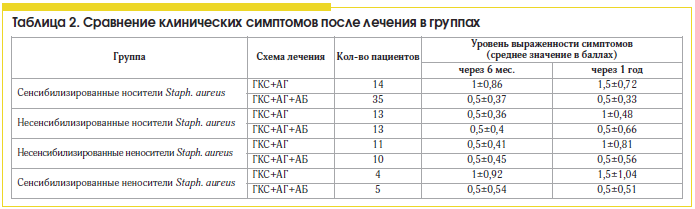
Сравнивая различные схемы лечения ПРС, мы установили, что больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии (табл. 2 и 3) топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения антибактериальной терапии.

Как известно, выбор антибиотика зависит от определенных факторов: срока последнего обострения (менее 6 мес.); результатов микробиологического исследования; тяжести течения заболевания; наличия осложнений. Все пациенты с хроническим синуситом в несколько раз чаще применяют антибактериальные препараты, что значительно повышает риск встречи с резистентной флорой. Уже этот фактор служит показанием к назначению антибиотиков, резистентность к которым минимальна.
В этом аспекте понятен повышенный интерес оториноларингологов к респираторным фторхинолонам, в частности к левофлоксацину – высокоэффективному в отношении респираторной флоры, с практическим отсутствием резистентных штаммов в России, который, к тому же в терапевтических концентрациях способствует ингибированию синтеза биопленки.
Заключение
В нашем исследовании применение антибиотиков в составе комплексной терапии ПРС, ассоциированного с персистирующей стафилококковой инфекцией, приводит к статистически достоверному (в 2 раза) уменьшению выраженности эозинофильного воспаления и улучшению клинических показателей заболевания (клинических симптомов, картины компьютерной томографии околоносовых пазух) и снижению частоты гнойных осложнений по сравнению со стандартной противорецидивной терапией.
Фторхинолоны − это полностью синтетические препараты, которые не имеют природного аналога. Одной из последних разработок препаратов данной группы является левофлоксацин. Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, − топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2−3 ч) субингибирующим действием [9].
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина. Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в т. ч. внутриклеточные возбудители [10]. При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что по противомикробной активности левофлоксацин превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в т. ч. пенициллин-резистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин − 92%, ципрофлоксацин − 82%, кларитромицин − 96%, азитромицин − 94%, амоксициллин/клавуланат − 96%, цефуроксим − 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин-чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии [11]. Важным преимуществом левофлоксацина, наряду с хорошей переносимостью, является возможность однократного приема в течение суток.
Перечисленные характеристики препарата обусловливают чрезвычайно важное в практическом отношении свойство левофлоксацина – высокую комплаентность. Сокращение кратности приема и длительности лечения играют ключевую роль в формировании лучшей приверженности протоколам антибиотикотерапии.
Таким образом, левофлоксацин высокоактивен относительно основных возбудителей бактериального синусита. Как показали исследования, чувствительность пневмококка, гемофильной палочки, моракселлы к левофлоксацину превышает 99%. Отмечается также низкий уровень устойчивости золотистого стафилококка (его метициллин-резистентных штаммов) и других возбудителей синусита.
Источник